Công thức cần nhớ Hóa vô cơ
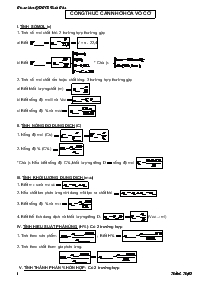
TÍNH SỐ MOL (n)
1. Tính số mol chất khí: 2 trường hợp thường gặp
a/ Biết V = n . 22,4
b/ Biết * Chú ý:
2. Tính số mol chất rắn hoặc chất lỏng: 3 trường hợp thường gặp
a/ Biết khối lượng chất (m)
b/ Biết nồng độ mol/l và Vdd
c/ Biết nồng độ % và mdd
Bạn đang xem tài liệu "Công thức cần nhớ Hóa vô cơ", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
CÔNG THỨC CẦN NHỚ HÓA VÔ CƠ I. TÍNH SỐ MOL (n) 1. Tính số mol chất khí: 2 trường hợp thường gặp a/ Biết V = n . 22,4 b/ Biết * Chú ý: 2. Tính số mol chất rắn hoặc chất lỏng: 3 trường hợp thường gặp a/ Biết khối lượng chất (m) b/ Biết nồng độ mol/l và Vdd c/ Biết nồng độ % và mdd II. TÍNH NỒNG ĐỘ DUNG DỊCH (C) 1. Nồng độ mol (CM) 2. Nồng độ % (C%) * Chú ý: Nếu biết nồng độ C%, khối lượng riêng D nồng độ mol III. TÍNH KHỐI LƯỢNG DUNG DỊCH (mdd) 1. Biết mc.tan và md.môi 2. Nếu chất tan phản ứng với dung môi tạo ra chất khí 3. Biết nồng độ % và mct 4. Biết thể tích dung dịch và khối lượng riêng D: (Vdd → ml) IV. TÍNH HIỆU SUẤT PHẢN ỨNG (H%): Có 2 trường hợp 1. Tính theo sản phẩm: ; Biết H% 2. Tính theo chất tham gia phản ứng: V. TÍNH THÀNH PHẦN % HỔN HỢP: Có 2 trường hợp 1. Tính thành phần % mA trong hổn hợp: 2. Tính thành phần % mA trong hợp chất: VI. TRẠNG THÁI, MÀU SẮC CÁC ĐƠN CHẤT, HỢP CHẤT VÔ CƠ Cr(OH)2 : vàng Cr(OH)3 : xanh K2Cr2O7 : đỏ da cam KMnO4 : tím CrO3 : rắn, đỏ thẫm Zn : trắng xanh Zn(OH)2 : ↓ trắng Hg : lỏng, trắng bạc HgO : màu vàng hoặc đỏ Mn : trắng bạc MnO : xám lục nhạt MnS : hồng nhạt MnO2 : đen H2S : khí không màu SO2 : khí không màu SO3 : lỏng, không màu, sôi 45oC Br2 : lỏng, nâu đỏ I2 : rắn, tím Cl2 : khí, vàng lục CdS : ↓ vàng HgS : ↓ đỏ AgF : tan AgI : ↓ vàng đậm AgCl : ↓ màu trắng AgBr : ↓ vàng nhạt HgI2 : đỏ CuS, NiS, FeS, PbS, : đen C : rắn, đen S : rắn, vàng P : rắn, trắng, đỏ, đen Fe : trắng xám FeO : rắn, đen Fe3O4 : rắn, đen Fe2O3 : màu nâu đỏ Fe(OH) 2 : rắn, màu trắng xanh Fe(OH)3 : rắn, nâu đỏ Al(OH)3: màu trắng, dạng keo tan trong NaOH Zn(OH)2 : màu trắng, tan trong NaOH Mg(OH)2 : màu trắng. Cu: : rắn, đỏ Cu2O : rắn, đỏ CuO : rắn, đen Cu(OH)2 : ↓ xanh lam CuCl2, Cu(NO3)2, CuSO4.5H2O : xanh CuSO4 : khan, màu trắng FeCl3 : vàng CrO : rắn, đen Cr2O3 : rắn, xanh thẫm BaSO4 : trắng, không tan trong axit. BaCO3,CaCO3: ↓trắng VII. HÓA TRỊ CỦA MỘT SỐ KIM LOẠI VÀ GỐC AXIT Kim loại Hóa trị Ion Hiđroxit/nhận biết K I K+ KOH tan Na I Na+ NaOH tan Ba II Ba2+ Ba(OH)2 ít tan Mg II Mg2+ Mg(OH)2↓ trắng (không tan trong kiềm dư) Al III Al3+ Al(OH)3↓ trắng (tan trong kiềm dư) Zn II Zn2+ Zn(OH)2↓ trắng (tan trong kiềm dư) Cu II(I) Cu2+ Cu(OH)2↓ xanh lam Ag I Ag+ AgOH↓ Ag2O↓đen + H2O Fe II và III Fe2+ và Fe3+ Fe(OH)2↓ lục nhạt Fe(OH)3↓ nâu đỏ Nitrat I NO3- 3Cu + 8HNO3(loãng) → 2Cu(NO3)2 + 2NO↑ + H2O 2NO + O2 2NO2↑ (màu nâu) Sunfat II SO42- SO42- + Ba2+ → BaSO4↓ trắng (không tan trong HCl) Sunfua II S2- S2- + Pb2+ → PbS↓ đen S2- + 2H+ → H2S↑ (mùi trứng thối) Hiđrosunfat I HSO3- 2HSO3- SO2↑ + SO32- + H2O Photphat III PO43- PO43- + 3Ag+ → Ag3PO4↓ vàng Cacbonat II CO32- CO32- + Ba2+ → BaCO3↓ trắng (tan trong HCl) Hiđrocacbonat I HCO3- 2HCO3- CO2↑ + CO32- + H2O Clorua I Cl- Cl- + Ag+ → AgCl↓ trắng (hóa đen ngoài ánh sáng) Bromua I Br- Br- + Ag+ → AgBr↓ vàng nhạt (hóa đen ngoài ánh sáng) Iotua I I- I- + Ag+ → AgI↓ vàng đậm (hóa đen ngoài ánh sáng) Silicat II SiO32- SiO32- + 2H+ → H2SiO3↓ keo Cromat II CrO42- CrO42- + Ba2+ → BaCrO4↓ vàng
Tài liệu đính kèm:
 Cong thuc giai toan hoa vo co.doc
Cong thuc giai toan hoa vo co.doc





