Giáo án Hóa học 10 - Kì II - Tiết 60: Kiểm tra 1 tiết
I.Mục tiêu:
1. Kiến thức:
- Hệ thống hoá kiến thức về nhóm oxi- lưu huỳnh,
- Kiểm tra quá trình tích luỹ kiến thức của học sinh
2. Kỹ năng:
- Đánh giá kĩ năng viết phương trình phản ứng hoá học, xác định chất oxi hoá, chất khử, cân bằng các phản ứng hoá học
- Giải được các bài tập có liên quan: bài tập nhận biết, phân biệt các chất, các bài toán
3.Giáo dục: ý thức làm việc khoa học, đam mê học tập cho học sinh
II. Chuẩn bị: HS làm bài tập và ôn lý thuyết
GV: Đề kiểm tra
Bạn đang xem tài liệu "Giáo án Hóa học 10 - Kì II - Tiết 60: Kiểm tra 1 tiết", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
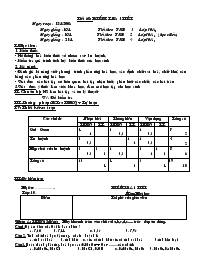
Tiết 60: Kiểm tra 1 tiết Ngày soạn: 12/4/2008 Ngày giảng:16/4 Tiết theo TKB 3 Lớp 10A1 Ngày giảng: 16/4 Tiết theo TKB 2 Lớp 10A2 (học chiều) Ngày giảng: 21/4 Tiết theo TKB 4 Lớp 10A3 I.Mục tiêu: 1. Kiến thức: - Hệ thống hoá kiến thức về nhóm oxi- lưu huỳnh, - Kiểm tra quá trình tích luỹ kiến thức của học sinh 2. Kỹ năng: - Đánh giá kĩ năng viết phương trình phản ứng hoá học, xác định chất oxi hoá, chất khử, cân bằng các phản ứng hoá học - Giải được các bài tập có liên quan: bài tập nhận biết, phân biệt các chất, các bài toán 3.Giáo dục: ý thức làm việc khoa học, đam mê học tập cho học sinh II. Chuẩn bị: HS làm bài tập và ôn lý thuyết GV: Đề kiểm tra III. Phương pháp: KTra TNKQ+ Tự luận IV:Thiết kế ma trận Các chủ đề Nhận biết Thông hiểu Vận dụng Tổng số TNKQ TL TNKQ TL TNKQ TL Oxi - Ozon 4 1 2 0,5 1 0.5 7 2 Lưu huỳnh 2 0,5 1 1 1 0,5 4 2 Hợp chất của lưu huỳnh 2 0.5 2 2 1 0,5 2 1 1 2 8 6 Tổng số 10 4 4 2 5 4 19 10 III: Đề kiểm tra: Họ tên:.. Lớp: 10 Kiểm tra 1 tiết Môn: Hoá học Điểm Lời phê của giáo viên *Phần A: TNKQ( 5điểm): Hãy khoanh tròn vào chữ cái a,b,c,d,e..... trước đáp án đúng. Câu1.Độ âm điện của Oxi là bao nhiêu ? a. 3,16 b. 3,44 c. 2,58 d. 3,98 Câu 2. Tính chất hoá học đặc trưng của lưu huỳnh là a. tính oxi hoá b. tính khử c. vừa có tính khử vừa có tính oxi hoá d.tính kim loại Câu3. Hoàn thành phản ứng hoá học sau: KMnO4 O2 + .........các chất là a. K2MnO4, MnCl2 b. MnCl2, KOH c. K2MnO4, MnO2 d. MnO4, K2MnO4 Câu 4: Không cần tính toán hãy cho biết phần trăm khối lượng oxi lớn nhất là ở chất nào sau đây? a. CuO b. Cu2O c. SO2 d. SO3 Câu 5. Cấu hình e lớp ngoài cùng của nguyên tố oxi và lưu huỳnh là a- ns2np5 b- ns2np6 c- ns2np3 d- ns2np4 Câu 6. Trong phản ứng hoá học sau, axit H2S thể hiện tính chất nào ? H2S + NaOH NaHS H2S + 2NaOH Na2S + 2H2O a- Tính axít yếu b- Tính axit mạnh c- Tính oxi hoá d- Tính khử Câu 7. Những chất nào là chất còn thiếu trong phản ứng sau H2SO4 + KBr Br2 + ......... a. SO3, H2O, K2SO4 b. SO2, I2, H2O c. SO2, H2O, K2SO4 d. H2SO3 , H2O, KOH Câu 8: 0,5 mol axit sunfuric tác dụng vừa đủ với 0,5 mol natri hiđroxit sản phẩm là a. 0,5 mol natri hiđro sunfat b. 0,5 mol natri sunfat c. 1 mol natri hiđro sunfat d. 1 mol natri sunfat Câu 9: Axit sunfric đặc nóng tác dụng được với tất cả các kim loại trong nhóm nào dưới đây? A. Au, Na, Mg , Zn b. Mg,Al, Fe, Zn c. Ag, Au, Al, Fe d. Cu, Al, Pt, Zn Câu10: Để phản ứng vừa đủ 200 ml dung dịch BaCl2 2M cần dùng 500 ml dung dịch Na2SO4 với nồng độ bao nhiêu? a. 0,1 M b. 0,4M c. 1,6M d. 0,8M Câu 11: Trong phản ứng hoá học sau, axit H2SO4 thể hiện tính chất nào ? H2SO4 + 2NaOH Na2SO4 + 2H2O a- tính axít b- tính bazơ c- tính oxi hoá d- tính khử Câu 12: Trong phòng thí nghiệm người ta điều chế oxi bằng cách nào? a. nhiệt phân hợp chất giàu oxi kém bền b. điện phân nước c. trưng phân đoạn không khí lỏng d. điện phân muối NaCl Câu 13: Cho phương trình hoá học sau: SO2 + KMnO4 + H2O →K2SO4 + MnSO4+ H2SO4 a. Hệ số cân bằng của các chất trong phản ứng là: a. 2,2,5,1,2,2 b. 5,2,2,1,2,2 c. 2,5,2,1,2,2 d. 2,1,2,5,2,2 b. Trong phản ứng trên SO2 đóng vai trò là a. chất khử b. chất oxi hoá c. vừa là chất khử, vừa là chất oxi hoá d. môi trường phản ứng Câu 14: Khi nhiệt phân 1g KMnO4 thì thu được bao nhiêu lít khí oxi ở đktc? a. 0,1l b. 0,3l c. 0,07 l d. 0,03l Câu 15: Từ 1,6 tấn quặng pirit sắt có chứa 60% FeS2 có thể sản xuất được bao nhiêu tấn H2SO4 (biết hiệu suất của quá trình sản xuất là 80%)? a. 1,568 tấn b. 0,96 tấn c. 1,2544 tấn d. 1,658 tấn Phần B: TNTL(5 điểm) Câu16: Hoàn thành sơ đồ phản ứng sau: S 1 SO22 SO33 H2SO4 4 SO2 5 S 6 Al2S3 1........................... 4 2. 5.. 3. 6.. Câu 17: Chứng minh tính oxi hoá mạnh của axit sunfuric?(Dẫn ra phản ứng hoá học cụ thể) Câu 18: Cho 2,74 gam hỗn hợp bột kim loại magie và sắt tác dụng với bột lưu huỳnh dư. Chất rắn thu được sau phản ứng hoà tan hoàn toàn bằng dung dịch H2SO4 loãng nhận thấy có 1,792 lít khí thoát ra (đktc) a, Viết phương trình hoá học của các phản ứng đã xảy ra. b, Xác định khối lượng mỗi kim loại trong hỗn hợp ban đầu c, Tính thành phần % khối lượng mỗi muối sunfat thu được Họ tên:.. Lớp: 10 Kiểm tra 1 tiết Môn: Hoá học Điểm Lời phê của giáo viên *Phần A: TNKQ( 5diểm): Hãy khoanh tròn vào chữ cái A, B,C,D,E..... trước đáp án đúng. Câu 1: Khi nhiệt phân 2g KMnO4 thì thu được bao nhiêu lít khí oxi ở đktc? a. 0,14l b. 0,3l c. 0,07 l d. 0,03l Câu 2. Tính chất hoá học đặc trưng của oxi là a. vừa có tính khử vừa có tính oxi hoá b. tính khử c. tính oxi hoá d.tính kim loại Câu3: Cho nửa phản ứng hoá học sau: FeS2 + O2 * Các chất sản phẩm phản ứng là a. K2MnO4, MnO2 b. FeCl2, SO2 c. FeO, SO2 d. Fe2O3, SO2 * Số phân tử SO2 được sinh ra từ phản ứng trên là a. 4 b. 6 c. 8 d.7 Câu 4: Hợp chất nào dưới đây trong đó lưu huỳnh có số oxi hoá là +4 A. H2S B. FeS C. SO2 D. H 2SO4 Câu 5. Cấu hình e lớp ngoài cùng của ion O2- và S2- là a- ns2np5 b- ns2np6 c- ns2np3 d- ns2np4 Câu 6. Trong phản ứng hoá học sau, axit H2SO4 thể hiện tính chất nào ? 2H2SO4 + Cu CuSO4 + SO2 + 2H2O a- tính axít yếu b- tính axit mạnh c- tính oxi hoá mạnh d- tính khử Câu 7. Những chất nào là chất còn thiếu trong phản ứng sau H2SO4 + KI I2 + ......... a. SO3, H2O, K2SO4 b. SO2, O2, H2O c. H2SO3 , H2O, KOH d. SO2, H2O, K2SO4 Câu 8: 1 mol axit sunfuric tác dụng vừa đủ với 1mol natri hiđroxit sản phẩm là a. 0,5 mol natri hiđro sunfat b. 0,5 mol natri sunfat c. 1 mol natri hiđro sunfat d. 1 mol natri sunfat Câu 9: Axit sunfric đặc nóng tác dụng được với tất cả các kim loại trong nhóm nào dưới đây? a. Au, Na, Mg , Zn b. Mg,Al, Fe, Zn c. Ag, Au, Al, Fe d. Cu, Al, Pt, Zn Câu10: Để phản ứng vừa đủ 400 ml dung dịch BaCl2 2M cần dùng 500 ml dung dịch Na2SO4 với nồng độ bao nhiêu? a. 0,1 M b. 0,4M c. 1,6M d. 0,8M Câu 11: Để sản xuất axit sunfuric người ta dùng phương pháp nào? a. Phương pháp điện phân b. Phương pháp nhiệt phân c. Phương pháp tiếp xúc d. Phương pháp trưng phân đoạn không khí lỏng Câu 12: Cho các chất sau: S, SO2 , H2S, H2SO4, có mấy chất vừa có tính khử, vừa có tính oxi hoá? a. 1 b. 2 c. 3 d. 4 Câu13: Độ âm điện của lưu huỳnh là bao nhiêu ? a. 3,16 . b.3,98 c. 2,58 d. 3,44 Câu 14: Để nhận biết ion gốc axit trong muối magie sufat và muối sắt (III) sunfat có thể dùng hoá chất nào dưới đây? a. NaNO3 b. CaCl2 c. BaCO3 d. BaCl2 Câu 15: Nung 273,40 g hỗn hợp KClO3 và KMnO4 thu được 49,28 l khí oxi(đktc). Số mol KMnO4 đã tham gia phản ứng là a. 0,8mol b. 0,9 mol c. 0,6 mol d. 0,5mol Phần B: TNTL(5 điểm) Câu16: Hoàn thành sơ đồ phản ứng sau: FeS2 1 SO2 2 SO3 3 H2SO4 4 Al2(SO4)3 5 AlCl3 1........................... 4 2. 5.. 3. 6.. Câu 17: Chứng minh tính oxi hoá mạnh của axit sunfuric?(Dẫn ra phản ứng hoá học cụ thể) Câu 18: Cho 2,74 gam hỗn hợp bột kim loại nhôm và sắt tác dụng với bột lưu huỳnh dư. Chất rắn thu được sau phản ứng hoà tan hoàn toàn bằng dung dịch H2SO4 loãng nhận thấy có 1,792 lít khí thoát ra (đktc) a, Viết phương trình hoá học của các phản ứng đã xảy ra. b, Xác định thành phần % khối lượng mỗi kim loại trong hỗn hợp ban đầu. c. Tính khối lượng chất rắn thu được
Tài liệu đính kèm:
 Tiet 60KT10coban.doc
Tiet 60KT10coban.doc





