Giáo án môn Hóa học lớp 10 - Tiết 3 đến tiết 11
I- Mục tiêu:
1. Về kiến thức:
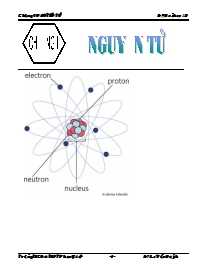
- Nguyên tử gồm hạt nhân mang điện tích dương và vỏ electron mang điện tích âm; kích thước, khối lượng của nguyên tử.
- Hạt nhân gồm các hạt proton (p) và nơtron (n).
- Kí hiệu, khối lương và điện tích của electron, proton và nơtron.
2. Về kỹ năng:
- So sánh khối lượng của electron, proton với nơtron.
- So sánh kích thước của hạt nhân với electron và với nguyên tử.
II- Chuẩn bị:
1. Giáo viên: Tranh vẽ hình 1.3 và hình 1.4 của SGK
2. Học sinh: Xem trước bài học.
III- Tiến trình dạy học:
Bạn đang xem 20 trang mẫu của tài liệu "Giáo án môn Hóa học lớp 10 - Tiết 3 đến tiết 11", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
Ngµy so¹n : 29/08/2010 TuÇn 2: Ngµy d¹y : 30/08/2010 TiÕt 3 THµNH PHÇN NGUY£N Tö I- Mục tiêu: 1. Về kiến thức: - Nguyên tử gồm hạt nhân mang điện tích dương và vỏ electron mang điện tích âm; kích thước, khối lượng của nguyên tử. - Hạt nhân gồm các hạt proton (p) và nơtron (n). - Kí hiệu, khối lương và điện tích của electron, proton và nơtron. 2. Về kỹ năng: - So sánh khối lượng của electron, proton với nơtron. - So sánh kích thước của hạt nhân với electron và với nguyên tử. II- Chuẩn bị: 1. Giáo viên: Tranh vẽ hình 1.3 và hình 1.4 của SGK 2. Học sinh: Xem trước bài học. III- Tiến trình dạy học: TG Hoạt động của GV Hoạt động của HS Nội dung 3’ 10’ 10’ 5’ 10’ 7’ Hoạt động 1: - Hãy đọc đoạn văn lịch sử về luận điểm nhà triết học Đemôcrit, từ đó hãy cho biết ý kiến: “ Các chất được tạo nên từ các hạt cực kì nhỏ bé không thể phân chia được nũa, gọi là nguyên tử.” có đúng không? Hoạt động 2: - Hãy quan sát hình 1.3, tìm hiểu thí nghiệm của Thom – son về sự tìm ra electron. Mô tả lại thí nghiệm đó, từ kết quả thu được ta rút ra được điều gì? - Vậy tia âm cực có phải là vật chất thực hay không, làm sao chứng minh được điều đó? Mô tả thí nghiệm 2. - Tia âm cực là vật chất thực, nó có mang điện hay không? Mô tả thí nghiệm 3 để học sinh quan sát và nhận xét. - Dựa vào SGK hãy cho biết electron có khối lượng và điện tích bằng bao nhiêu? Hoạt động 3: - Nguyên tử trung hòa về điện, ta tím ra được nguyên tử có phần mang điện tích âm là electron thì sẽ có phần khác của nguyên tử mang điện tích dương. - Cho HS quan sát hình 1.4 và mô tả thí nghiệm của Rodopho. Từ đó rút ra kết luận về kết quả thí nghiệm. Hoạt động 4: - Hạt nhân nguyên tử là thành phần không phân chia được nữa hay được cấu tạo từ những phần tử nhỏ hơn? Mô tả thí nghiệm của Rodopho năm 1918 và Chat – uýt năm 1932 để trả lời cho câu hỏi trên. Hoạt động 5: - Do nguyên tử, hạt nhân, e, p, n, là những hạt có kích thước và khối lượng rất nhỏ nên ta dùng đơn vị khác để xác định khối lượng và kích thước. - Đối với kích thước ta dùng đơn vị nanomet (nm) hay angstrom () để đo. Với: 1 nm = 10–9 m 1 = 10–10 m 1 nm = 10 - Nghiên cứu SGK cho biết kích thước của nguyên tử nhỏ nhất? Hạt nhân, e, p. - Đối với khối lượng của nguyên tử, phân tử, e, p, n ta dùng khối lượng nguyên tử (u hay đvC)) để biểu thị, Với: 1u bằng khối lượng của 1 nguyên tử đồng vị Cacbon –12. 1u = = 1,6605.10–27kg - Tính khối lượng nguyên tử (u) của 1 nguyên tử cacbon có khối lượng 19,9265.10–27 kg? Hido 1,6738.10–27kg? oxi 26568.10-26kg? Hoạt động 6: Cũng cố bài - Hình thành cho học sinh sơ đồ cấu tạo nguyên tử: - Làm các bài tập 1, 2, 3 trong SGK tr 9 - HS đọc đoạn văn trong SGK và trả lời câu hỏi của giáo viên. Quan niệm này không còn đúng nũa do các nhà bác học Thomson và các nhà bác học khác đã tìm ra hạt nhỏ bé hơn nguyên tử. - HS quan sát và lắng nghe lời giảng của giáo viên: Khi tiến hành thí nghiệm 1 cho phóng điện qua ống đã hút hết không khí thì phát hiện hiện tượng thành thủy tinh có chứa mà huỳnh quang phát sáng do những tia phát ra từ cực âm gọi là tia âm cực. - Qua thí nghiệm 2 cho thấy trên đương đi của tia âm cực đặt thêm chong chóng thì chong chóng bị quay do sự va chạm của tia âm cực. - Khi cho cùm tia âm cực đi qua các bản điện cực trái dấu thì chùm tia này bị lệch lề phía bản điện cực dương, điều này chứng này tỏ rắng tia âm cực là chùm hạt mang điện tích âm. - me = 9,1094.10–31kg - qe = – 1,602.10–19C 1,602.10–19 là diện tích đơn vị, kí hiệu eo. Vì vậy điện tích của electron là – eo và quy ước bằng 1– - Kết quả thí nghiệm cho ta thấy: nguyên tử có chứa phần điện tích dương, có khối lượng lớn và có kích thước nhỏ gọi là hạt nhân. - Nguên tử có cấu tạo rỗng, xung quanh hạt nhân có các electron chuyển động xung quanh tạo thành lớp vỏ electron. - Khối lượng nguyên tử tập trung chủ yếu ở hạt nhân nguyên tử - Hạt nhân nguyên tử còn được cấu tạo từ những hạt nhỏ hơn là proton và notron. Với khối lượng của 2 hạt xấp xỉ nhau bằng 1,6726.10–27kg. Proton mang 1 đơn vị điện tích dương 1+, nơtron không mang điện. - HS nghe giảng và ghi bài vào vở. - Nguyên tử nhỏ nhất là nguyên tử hidro có bk khoảng 0,053nm. - Đường kính của nguyên tử khoảng 10–1nm, đường kính của hạt nhân nguyên tử khoảng 10–5nm, đường kính của e, p, n còn nhỏ hơn nữa khoảng 10–8nm. - HS nghe giảng, ghi bài. - Nguyên tử cacbon có khối lượng nguyên tử là 12u, hidro là 1u, oxi là 16u. - me = 0,0005u - qe = 1 – (đvđt) - mp = 1u - qp = 1 + (đvđt) - mn = 1u - qn = 0 - Ngày nay với sự tiến bộ của khoa học và kỹ thuật, các nhà bác học đã tìm ra các hạt nhỏ hơn như electron, proton và nơtron. I. Thành phần cấu tạo của nguyên tử: 1. Electron a. Sự tìm ra electron - Sự phát hiện tia âm cực của Thomson là một trong những chứng cứ chứng tỏ nguyên tử có cấu tạo phức tạp. - Tia âm cực là một chùm vật chất có thực chuyển động rất nhanh. - Tia âm cực là chùm hạt mang điện tích âm và những hạt tạo thành tia âm cực được gọi là electron, kí hiệu e. b. Khối lượng và điện tích của electron: Bằng thực nghiệm ngường ta xác định được: - me = 9,1094.10–31kg - qe = – 1,602.10–19C 1,602.10–19 là diện tích đơn vị, kí hiệu eo. Vì vậy điện tích của electron là – eo và quy ước bằng 1–. 2. Sự tìm ra hạt nhân nguyên tử: - Nguyên tử có cấu tạo rỗng, phần mang điện tích dương là hạt nhân. - Xung quanh hạt nhân có các electron chuyển động tạo thành vỏ nguyên tử. khối lượng của nguyên tử hầu như tập trung ở hạt nhân. 3. Cấu tạo của hạt nhân nguyên tử: a. Sự tìm ra proton: - Năm 1918, Rodopho dùng tia α bắn phá hạt nhân nguyên tử nitơ tạo thành nguyên tử oxi và 1 loại hạt có khối lượng 1,6726.10–27 mang 1 đơn vị điện tích dương gọi là hạn proton (KH: n). Vậy, hạt proton là 1 thành phần của hạt nhân nguyên tử. b. Sự tìm ra nơtron: - Năm 1932, Chat-uýt cũng phát hiện trong hạt nhân có 1 loại hạt mới có khối lượng xấp xỉ proton nhưng không mang điện, được gọi là nơtron (KH: n).Vậy nơtron cũng là 1 thành phần cấu tạo của hạt nhân nguyên tử. II. Kích thước và khối lượng của nguyên tử - Nguyên tử của các nguyên tố khác nhau thì có kích thước và khối lượng khác nhau. 1. Kích thước: - Nếu coi nguyên tử có dạng hình cầu có các electron chuyển động xung quanh hạt nhân thì nguyên tử có đường kính khoảng 10–10m - Do nguyên tử có kích thước nhỏ nên ta sử dụng đơn vị nanomet (vt: nm) hay angstrom (vt: ) để đo kích thước nguyên tử. 1 nm = 10–9 m 1 = 10–10 m 1 nm = 10 - Nguyên tử nhỏ nhất là nguyên tử hidro có bk khoảng 0,053nm. - Đường kính của nguyên tử khoảng 10–1nm, đường kính của hạt nhân nguyên tử khoảng 10–5nm, đường kính của e, p, n còn nhỏ hơn nữa khoảng 10–8nm. 2. Khối lượng: - Để biểu thị khối lượng của nguyên tử, phân tử và các hạt p, n, e người ta phải dùng đơn vị khối lượng nguyên tử, kí hiệu: u, còn được gọi là đvC 1u bằng khối lượng của 1 nguyên tử đồng vị Cacbon –12. - Nguyên tử Cacbon này có khối lượng 19,9265.10–27kg. 1u = = 1,6605.10–27kg - Nguyên tử hidro có khối lượng 1,6738.10–27kg 1u. - Nguyên tử cacbon có khối lượng 19,9265.10-27kg12u. IV. DẶN DÒ: Về nhà làm bài tập 4, 5 SGK trang 9 Xem trước bài mới. V. RÚT KINH NGHIỆM: Ngµy so¹n : 29/08/2010 TuÇn 2: Ngµy d¹y : 31/08/2010 TiÕt 4 H¹t nh©n nguyªn tö – nguyªn tè ho¸ häc - ®ång vÞ I- Mục tiêu: 1. Về kiến thức: - Nguyên tố hóa học bao gồm những nguyên tử có cùng đơn vị điện tích hạt nhân. - Số hiệu nguyên tử (Z) = số đơn vị điện tích hạt nhân = số electron có trong nguyên tử. - Kí hiệu số hiệu nguyên tử X: kí hiệu nguyên tố hóa học A: tổng số proton và nơtron 2. Về kỹ năng: - Xác định được số electron, số proton, số nơtron khi biết kí hiệu nguyên tử và số khối của nguyên tử và ngược lại. 3. Về tư tưởng: - Hứng thú học tập môn hóa học. - Giáo dục cho học sinh về lòng tin vào khả năng của con người có thể tìm ra cấu tạo nguyên tử, bản chất của thế giới vật chất. II- Chuẩn bị: 1. Giáo viên: Giáo án, hệ thống câu hỏi giúp học sinh học bài. 2. Học sinh: Xem trước bài học, nắm vững đặc điểm các hạt cấu tạo nên hạt nhân nguyên tử. 3. Phương pháp: đàm thoại nêu vấn đề. III- Tiến trình dạy học: TG Hoạt động của GV Hoạt động của HS Nội dung 5’ 10’ 10’ 10’ 10’ Hoạt động 1: Ổn định tổ chức, kiểm tra sỉ số, kiểm tra bài cũ. - Nêu thành phần cấu tạo nguyên tử và hạt nhân nguyên tử? Cho biết khối lượng, điện tích của e, p và n? Hoạt động 2: - Điện tích hạt nhân nguyên tử do thành phần nào quyết định? - Nguyên tử trung hòa về điện nên số proton trong hạt nhân bằng số electron của nguyên tử. Từ đó ta có nhận xét gì về điện tích hạt nhân, số proton và số electron? VD? - GV định nghĩa số khối. Sau đó, cho HS áp dụng công thức: A = Z + N để giải bài tập. Tính số khối của hạt nhân nguyên tử và xác định số electron trong nguyên tử: + Oxi (O) có 8p và 8n. + Beri (Be) có 4p và 5n. Hoạt động 3: - Tính chất hóa học của một nguyên tố phụ thuộc vào số e và do đó phụ thuộc vào số đơn vị điện tích hạt nhân nguyên tử Z của nguyên tử. Như vậy hạt nhân nguyên tử có cùng số đơn vị điện tích hạt nhân Z thì có cùng tính chất hóa học. - Nguyên tố hóa học là gì? - GV nhấn mạnh: Tính chất riêng biệt của nguyên tử chỉ được giữ nguyên khi điện tích hạt nhân nguyên tử đó được bảo toàn. Nếu điện tích hạt nhân nguyên tử bị thay đổi thì tính chất của nguyên tử cũng bị thay đổi theo. - Hãy phân biệt nguyên tử và nguyên tố? Hoạt động 4: - Nghiên cứu SGK cho biết số hiệu nguyên tử là gì? - Nếu biết A và số hiệu nguyên tử, ta có thể biết được số lượng các hạt cơ bản cấu tạo nên nguyên tử đó không? - Do số đơn vị điện tích hạt nhân và số khối được coi là đặc trưng cơ bản của nguyên tử nên người ta đặc các chỉ số trên kí hiệu hóa học: . VD: , , , - Kí hiệu của nguyên tử cho ta biết clo có bao nhiêu p, n, e? Hoạt động 5: Cũng cố tiết học Thảo luận phiếu học tập 1. Nguyên tố có tổng số hạt p, n, e là 34. Biết số n nhiều hơn số p là 1. Tính số khối của hạt nhân. 2. Nguyên tố X có tổng số hạt là 10. Xác định số khối của X là: A. 6 B. 7 C. 8 D. 9 - Nguyên tử được cấu tạo từ hạt nhân và electron. - Hạt nhân nguyên tử được cấu tạo từ các hạt proton và nơtron. - me = 9,1094.10- 31kg mp = mn = 1,6726.10- 27kg qe = – 1,602.10–19 C = 1– qp = 1,602.10–19 C = 1+ qn = 0 - Hạt nhân nguyên tử có cấu tạo từ 2 hạt proton và nơtron trong đó chỉ có proton mang điện nên điện tích của hạt nhân là do số p quyết định. - HS nhận xét: Số đơn vị điện tích hạt nhân Z = số proton = số electron. VD: Nitơ có điện tích hạt nhân là 7, vậy nguyên tử nitơ có 7p và 7e. - HS thảo luận theo nhóm sau đó cử đại diện ghi bài giải lên bảng. + Oxi: A = 8 + 8 = 16, trong nguyên tử có 8e. + Beri: A = 4 + 5 = 9, trong nguyên tử có 4e. - HS nghe giảng. - Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân. - Nguyên tử là nói đến 1 loại hạt vi mô trung hòa về điện gồm hạt nhân và lớp vỏ e. Nguyên tố là nói đến tập hợp các nguyên tử có c ... f chứa tối đa 14e. - HS điền vào bảng phụ. - Số e tối đa trên lớp n là 2.n2 - Lớp O là lớp thứ 5: n = 5 => 2.n2 = 50e. Vậy lớp O có tối đa là 50e. - Sự phân bố e trên các phân lớp: + K (n=1) có tối đa 2e, nên phân bố e trên phân lớp là: 1s2 + L (n=2) có tối đa 8e nên: 2s2 2p6 + M (n=3) có tối đa 18e nên: 3s2 3p6 3d10 - Vỏ nguyên tử có 7 lớp: K, L, M, N, O, P, Q - Số e tối đa trên lớp được tính bằng 2n2. Đáp án B. III. Số electron tối đa trong một phân lớp: - Phân lớp s chứa tối đa 2e - Phân lớp p chứa tối đa 6e - Phân lớp d chứa tối đa 10e - Phân lớp f chứa tối đa 14e Phân lớp đã có đủ số e tối đa gọi là phân lớp e bão hòa. Số e tối đa của lớp thứ nơtron là 2n2. - Số e tối đa trên phân lớp: Lớp Số e tối đa của lớp Phân bố e trên phân lớp K (n=1) 2 1s2 L (n=2) 8 2s2 2p6 M (n=3) 18 3s2 3p6 3d10 Bảng phụ: Lớp K n = 1 L n = 2 M n = 3 Phân lớp s s p s p d Số AO Số e tối đa của phân lớp Số e tối đa của lớp Lớp K n = 1 L n = 2 M n = 3 Phân lớp s s p s p d Số AO 1 1 3 1 3 5 Số e tối đa của phân lớp 2 2 6 2 6 10 Số e tối đa của lớp 2 8 18 IV. DẶN DÒ: Về nhà làm bài tập trong SGK và Sách Bài tập Hóa học 10. Xem trước bài mới. V. RÚT KINH NGHIỆM Ngµy so¹n : 19/09/2010 TuÇn 5: Ngµy d¹y : 21/09/2010 TiÕt 9 CÊU h×nh electron nguyªn tö I- Mục tiêu: 1. Về kiến thức: - Biết được các mức năng lượng trong nguyên tử. - Sự phân bố e trên lớp, phân lớp và cấu hình e nguyên tử của 20 nguyên tố đầu tiên. - Đặc điểm e ở lớp ngoài cùng: lớp ngoài cùng có nhiều nhất là 8e (ns2 np6), e lớp ngoài cùng của khí hiếm là 8e (riêng heli là 2e), hầu hết các kim loại đều có từ 1 → 3e ở lớp ngoài cùng, phi kim là 5→7e. 2. Về kỹ năng: - Viết được cấu hình e nguyên tử của một số nguyên tố hóa học. - Dựa vào cấu hình e suy ra tính chất hóa học cơ bản của chúng. 3. Về tư tưởng: - Có hứng thú trong học tập hóa học. - Có tinh thần trách nhiệm đối với bản thân, gia đình và xã hội. II- Chuẩn bị: 1. Giáo viên: Giáo án và tranh ảnh, hệ thống câu hỏi. 2. Học sinh: Ôn tập kiến thức đã học. 3. Phương pháp: Đàm thoại nêu vấn đề. III- Tiến trình dạy học: TG Hoạt động của GV Hoạt động của HS Nội dung 7’ 10’ 15’ 8’ 5’ Hoạt động 1: Ổn định tổ chức, Kiểm tra sỉ số, kiểm tra bài cũ. - Theo mô hình hành tinh nguyên tử của Bo, Rodopho và Zommophen thì các e chuyển động ntn? Nó có ý nghĩa gì? Quan niệm ngày nay về sự chuyển động này ra sao? - Có bao nhiêu lớp? kể tên lớp và phân lớp. Số e tối đa trên lớp? Hoạt động 2: - Cho HS quan sát tranh sơ đồ phân bố các mức năng lượng của lớp và phân lớp. Hãy nhận xét? - Hãy sắp xếp các mức năng lượng trong nguyên tử? - TB: Mức năng lượng của các lớp tăng theo thứ tự từ 1 đến 7. khi Z tắng thì xảy ra sự chèn mức năng lượng làm cho mức năng lượng 3d > 4s, 5d > 4f >6s, Hoạt động 3: - Quan sát bảng cấu hình e nguyên tử của 20 nguyên tố đầu trong SGK. - Cấu hình e nguyên tử biểu diễn sự phân bố e trên phân lớp thuộc các lớp khác nhau. - GV trình bài qui ước viết cấu hình e: + Số thứ tự lớp được ghi bằng chữ số (1, 2, 3,) + phân lớp được ghi bằng chữ cái thường (s, p, d, f,..). + Số e được ghi bằng số ở phía trên bên phải của phân lớp (s2, p6,) - Nghiên cứu SGK hãy nêu cách viết cấu hình e của nguyên tố? - Xét ví dụ về cấu hình của Li: 1s2 2s1. e cuối cùng của nguyên tử được điền vào lớp s → Li là nguyên tố s. Vậy dựa vào bảng SGK cho biết Cl, là nguyên tố gì? - Thế nào là nguyên tố s, p, d, f? - Viết cấu hình e của nguyên tố sắt (Z = 26). Cho biết Fe là nguyên tố gì? Hoạt động 4: - Cho HS tự chọn Z từ 1 → 20 để viết cấu hình của nguyên tố đó, sau đó đối chiếu với SGK. - Nghiên cứu bảng SGK cho biết nguyên tử chỉ có thể có tối đa bao nhiêu e ở lớp ngoài cùng? - TB: Nguyên tử có 8e ở ngoài cùng (ns2 np6) đều rất bền vững chúng không tham gia vào phản ứng hóa học (trừ một số trường hợp đặc biệt). Đó là các nguyên tố khí hiếm. - Hãy viết cấu hình e của các nguyên tử Na, Ca, Al, O, Cl, N và cho biết chúng có bao nhiêu e ở lớp ngoài cùng? - Hướng dẫn HS rút ra kết luận: - TB: Các nguyên tử có 4 electron ở lớp ngoài cùng có thể là nguyên tử của nguyên tố kim loại (nếu thuộc chu kì lớn) hoặc phi kim (nếu thuộc chu kì nhỏ). Hoạt động 5: Cũng cố bài - Viết cấu hình e của nguyên tử M (Z=33) cho biết chúng thuộc nguyên tố gì? Là kim loại hay phi kim? - Theo mô hình HTNT thì các e chuyển động xung quanh hạt nhân theo 1 quỹ đạo xác định hình tròn hay hình bầu dục. mô hình này có ý nghĩa rất lớn đến sự phát triển của lý thuyết cấu tạo nguyên tử nhưng nó không giải thích được một số tính chất của nguyên tử. - Ngày nay, ta đã xđ được e chuyển động rất nhanh xung quanh hạt nhân không theo quĩ đạo xđ tạo thành lớp võ nguyễn tử. - Có 7 lớp: K, L, M, N, O, P, Q. phân lớp s, p, d, f, Số e tối đa trên lớp là 2n2 - Các e nguyên tử ở trạng thái cơ bản chiếm các mức năng lượng từ thấp đến cao - Mức năng lượng electron được xắp xếp: 1s 2s 2p 3s 3p 4s 3d 4p 5s - HS quan sát. - HS ghi bài - Cách viết cấu hình e của các nguyên tố: + Bước 1: Xác định số electron của nguyên tử + Bước 2: Phân bố các electron theo mức năng lượng từ thấp đến cao + Bước 3: Viết cấu hình electron biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau (1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s...) - Nguyên tử Cl thuộc nguyên tố p. - Nguyên tố s là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s. - Tương tự đối với các nguyên tố s, p, d, f. + Fe có Z = 26 nên có 26e + Thứ tự năng lượng: 1s2 2s2 2p6 3s2 3p6 4s2 3d6 + Cấu hình e: 1s2 2s2 2p6 3s2 3p6 3d6 4s2 → Fe là nguyên tố d. (dựa theo mức năng lượng). - HS viết cấu hình e với nguyên tố đã chọn. - Tất cả các nguyên tử của nguyên tố, lớp ngoài cùng có tối đa là 8e (trừ He). - HS nghe giảng và ghi bài - HS viết cấu hình và NX: + Na có 1e ở lớp ngoài cùng. + Ca có 2e ở lớp ngoài cùng. + Al có 3e ở lớp ngoài cùng. + O có 6e ở lớp ngoài cùng. + Cl có 7e ở lớp ngoài cùng. + N có 5e ở lớp ngoài cùng. - HS rút ra kết luận: + Các nguyên tử có 1,2,3 electron ở lớp ngoài cùng dễ nhường electron là nguyên tử của nguyên tố kim loại + Các nguyên tử có 5,6,7 electron ở lớp ngoài cùng dễ nhận electron là nguyên tử của nguyên tố phi kim + Những nguyên tố khí hiếm có 8e ở lớp ngoài cùng. - M (Z = 33) nên có 33e - các mức năng lượng: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3 - Cấu hình e: 1s2 2s2 2p6 3s2 3p6 4s2 4p3 3d10 → M có 5e ở lớp ngoài cùng nên nó là phi kim. I. Thứ tự các mức năng lượng trong nguyên tử - Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các mức năng lượng từ thấp đến cao. - Mức năng lượng electron được xắp xếp: 1s 2s 2p 3s 3p 4s 3d 4p 5s II. Cấu hình electron nguyên tử 1. Cấu hình electron nguyên tử: Cấu hình electron của nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau. Người ta quy ước viết cấu hình như sau: + Số thứ tự lớp được ghi bằng chữ số (1, 2, 3,) + phân lớp được ghi bằng chữ cái thường (s, p, d, f,..). + Số e được ghi bằng số ở phía trên bên phải của phân lớp (s2, p6,) - Cách viết cấu hình e của các nguyên tố: + Bước 1: Xác định số electron của nguyên tử + Bước 2: Phân bố các electron theo mức năng lượng từ thấp đến cao + Bước 3: Viết cấu hình electron biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau (1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s...) - Nguyên tố s là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s. - Nguyên tố p là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p. - Nguyên tố d là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d. - Nguyên tố f là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f. 2. Cấu hình nguyên tử của 20 nguyên tố đầu:(Tr.26 SGK) 3. Đặc điểm của lớp electron ngoài cùng: - Đối với tất cả các nguyên tố, lớp electron ngoài cùng có nhiều nhất là 8 electron. - Các nguyên tử có 8 electron ngoài cùng (ns2np6) và nguyên tử heli không tham gia liên kết hóa học, đây là nguyên tố khí hiếm. - Các nguyên tử có 1,2,3 electron ở lớp ngoài cùng dễ nhường electron là nguyên tử của nguyên tố kim loại - Các nguyên tử có 5,6,7 electron ở lớp ngoài cùng dễ nhận electron là nguyên tử của nguyên tố phi kim - Các nguyên tử có 4 electron ở lớp ngoài cùng có thể là nguyên tử của nguyên tố kim loại hoặc phi kim. Khi biết cấu hình electron của nguyên tử có thể dự đoán được loại nguyên tố. IV. DẶN DÒ: Về nhà làm bài tập trong Sách Bài tập Hóa học 10. Xem trước bài mới. V. RÚT KINH NGHIỆM Ngµy so¹n : 19/09/2010 TuÇn 5,6: Ngµy d¹y : 22-28/09/2010 TiÕt 10, 11 LUYÖN TËP: CÊU T¹O vá nguyªn tö I- Mục tiêu : 1/ Kiến thức : Học sinh nắm vững : Vỏ nguyên tử gồm có các lớp và phân lớp electron. Các mức năng lượng của lớp, phân lớp. Số electron tối đa trong một lớp, một phân lớp. Cấu hình electron của nguyên tử. 2/ Kĩ năng : Học sinh được rèn luyện về một số dạng bài tập liên quan đến cấu hình electron lớp ngoài cùng của nguyên tử 20 nguyên tố đầu. Từ cấu hình electron của nguyên tử suy ra tính chất tiêu biểu của nguyên tố đó. II- Chuẩn bị: 1. Gio vin: Sơ đồ phân bố mức năng lượng của các lớp và phân lớp. Phiếu học tập. 2. Học sinh: Xem lại bi cũ 3. Phương pháp: Phương pháp thảo luận nhóm kết hợp với sử dụng đồ dùng dạy học. III- Tiến trình giảng dạy: TG Hoạt động của GV Hoạt động của HS Nội dung 10’ 15’ 45’ Hoạt động 1 : + Yêu cầu học sinh xem bảng 3, 4 tr.29 SGK Hoạt động 2 : + Các nhóm thảo luận theo các câu hỏi trong phiếu học tập. Phiếu học tập số 1 : Về mặt năng lượng các electron như thế nào được xếp vào một lớp, một phân lớp ? Phiếu học tập số 2 : Số electron tối đa ở lớp thứ n là bao nhiêu ? Phiếu học tập số 3 : Lớp thứ n có bao nhiêu phân lớp ? Lấy ví dụ với n = 1, 2, 3, 4. Phiếu học tập số 4 : Sắp xếp các phân lớp theo thứ tự mức năng lượng từ thấp đến cao. Phiếu học tập số 5: Qui tắc viết cấu hình electron nguyên tử của một nguyên tố. Phiếu học tập số 6 : Số electron lớp ngoài cùng ở nguyên tử của một nguyên tố cho biết tính chất hóa học điển hình gì của nguyên tử nguyên tố đó ? Hoạt động 3: Làm bài tập 1 ® 9 tr.30 SGK 1. Lớp và phân lớp electron: Xem bảng 3 tr.29 SGK 2. Mối liên hệ giữa lớp electron ngoài cùng với loại nguyên tố: Xem bảng 4 tr.29 SGK + Electron có mức năng lượng gần bằng nhau được xếp vào một lớp. + Electron có mức năng lượng bằng nhau được xếp vào một phân lớp. + Số electron tối đa của một lớp = 2n2, của phân lớp s là 2 ; p là 6 ; d là 10 ; f là 14. + Thứ tự năng lượng của các phân lớp từ thấp đến cao là : 1s 2s 2p 3s 3p 4s 3d 4p + Qui tắc viết cấu hình electron: + Đặc điểm của lớp electron ngoài cùng: ® Số electron lớp ngoài cùng ở nguyên tử của một nguyên tố cho biết nguyên tố đó là kim loại, phi kim hay khí hiếm. IV: Dặn dò: - Về nhà chuẩn bị bài mới. V. Rút kinh nghiệm:
Tài liệu đính kèm:
 Hoa hoc 10 chuong I.doc
Hoa hoc 10 chuong I.doc





