Bảng tường trình bài thực hành số 3 tính chất và hợp chất của các Halogen
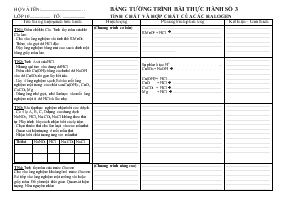
TN1: Điều chế khí Clo. Tính tẩy màu của khí Clo ẩm:
- Cho vào ống nghiệm vài tinh thể KMnO4
- Thêm vài giọt dd HCl đặc
- Đậy ống nghiệm bằng nút cao su có đính một băng giấy màu ẩm.
TN2: Tính Axit của HCl.
- Nhúng quì tím vào dung ddHCl
- Điều chế Cu(OH)2 bằng cách nhỏ dd NaOH vào dd CuSO4 rồi gạn lấy kết tủa.
- Lấy 4 ống nghiệm sạch. Bỏ vào mỗi ống nghiệm một trong các chất sau Cu(OH)2, CuO, CaCO3, Mg
- Dùng ống nhỏ giọt, nhỏ lần lược vào mỗi ống nghiệm một ít dd HCl và lắc nhẹ.
Bạn đang xem tài liệu "Bảng tường trình bài thực hành số 3 tính chất và hợp chất của các Halogen", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
HỌ VÀ TÊN:.......................................... BẢNG TƯỜNG TRÌNH BÀI THỰC HÀNH SỐ 3 LỚP 10.................... TỔ: ...................... TÍNH CHẤT VÀ HỢP CHẤT CỦA CÁC HALOGEN Tên thí nghiệm, cách tiến hành Hiện tượng Phương trình phản ứng Kết luận – Giải thích TN1: Điều chế khí Clo. Tính tẩy màu của khí Clo ẩm: - Cho vào ống nghiệm vài tinh thể KMnO4 - Thêm vài giọt dd HCl đặc - Đậy ống nghiệm bằng nút cao su có đính một băng giấy màu ẩm. (Chương trình cơ bản) ............................................................................................................................................................................................................................ ................................................................................KMnO4 + HCl à ................................................. ................................................................................................................................................................................................................................................................................. ........................................................................................................................................................................................................................................................................ TN2: Tính Axit của HCl. - Nhúng quì tím vào dung ddHCl - Điều chế Cu(OH)2 bằng cách nhỏ dd NaOH vào dd CuSO4 rồi gạn lấy kết tủa. - Lấy 4 ống nghiệm sạch. Bỏ vào mỗi ống nghiệm một trong các chất sau Cu(OH)2, CuO, CaCO3, Mg - Dùng ống nhỏ giọt, nhỏ lần lược vào mỗi ống nghiệm một ít dd HCl và lắc nhẹ. ............................................................................................................................................................................................................................................................................................................................................................... Sự phân li tạo H+ ... CuSO4 + NaOH à Cu(OH)2+ HCl ..................................................... CuO + HCl à ................................................ CaCO3 + HCl à.................................................. Mg + HCl à ................................................. ................................................................................................................................................................................................................................................................................................................................................................ TN3: Bài tập thực nghiệm nhận biết các ddịch. - Có 4 lọ A, B, C, D đựng các dung dịch NaNO3, HCl, Na2CO3, NaCl không theo thứ tự. Hãy trình bày cách nhận biết các lọ trên. - Chọn thuốc thử cho lần lượt vào các mẫu thử. - Quan sát hiện tượng ở mỗi mẫu thử. - Nhận biết chất tương ứng với mẫu thử Th/thử NaNO3 HCl Na2CO3 NaCl .................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... ................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................ .................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... TN4: Tính tẩy màu của nước Giaven Cho vào ống nghiệm khoảng 1ml nước Giaven. Bỏ tiếp vào ống nghiệm một miếng vải hoặc giấy màu. Để yên một thời gian. Quan sát hiện tuợng. Nêu nguyên nhân (Chương trình nâng cao) ............................................................................................................................................................................................................................ ................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................ ........................................................................................................................................................................................................................................................................
Tài liệu đính kèm:
 phieu thuc hanh 11.doc
phieu thuc hanh 11.doc





