Giáo án Hóa học 10 - Tiết 21: Kiểm tra 1 tiết – bài viết số 2
Tiết 21
Kiểm tra 1 tiết – bài viết số 2
I) MỤC TIÊU:
1/ Kiến thức:
-Các nội dung của chương như: Chu kì, nhóm, số thứ tự.
-Từ cấu hình electron suy ra vị trí nguyên tố, sự biến đổi tuần hoàn các tính chất.
-Đánh giá kết quả học tập của HS qua việc làm bài kiểm tra.
2/ Kĩ năng:
-Rèn luyện kĩ năng làm bài độc lập, tự chủ.
-Làm bài tập, nhớ lại lí thuyết đã học trong chương II.
-Rèn luyện kĩ năng trình bày bài làm khi kiểm tra và thi cử.
3/ Thái độ:
-Rèn luyện sự kiên trì, chịu khó học tập.
-Có ý thức học tập đúng đắn.
-Có ý thức vươn lên, tự rèn luyện bản thân để làm chủ kiến thức.
II) CHUẨN BỊ:
1/ Chuẩn bị của giáo viên:
-Đề kiểm tra, đáp án, biểu điểm.
2/ Chuẩn bị của học sinh:
-Chuẩn bị bài cũ của chương.
-Giấy làm bài, giấy nháp, bút mực, máy tính. để làm bài.
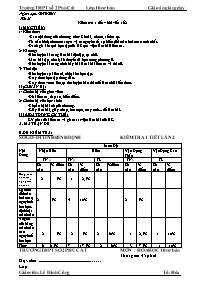
Ngày soạn: 30/10/2011 Tiết 21 Kiểm tra 1 tiết – bài viết số 2 I) MỤC TIÊU: 1/ Kiến thức: -Các nội dung của chương như: Chu kì, nhóm, số thứ tự. -Từ cấu hình electron suy ra vị trí nguyên tố, sự biến đổi tuần hoàn các tính chất. -Đánh giá kết quả học tập của HS qua việc làm bài kiểm tra. 2/ Kĩ năng: -Rèn luyện kĩ năng làm bài độc lập, tự chủ. -Làm bài tập, nhớ lại lí thuyết đã học trong chương II. -Rèn luyện kĩ năng trình bày bài làm khi kiểm tra và thi cử. 3/ Thái độ: -Rèn luyện sự kiên trì, chịu khó học tập. -Có ý thức học tập đúng đắn. -Có ý thức vươn lên, tự rèn luyện bản thân để làm chủ kiến thức. II) CHUẨN BỊ: 1/ Chuẩn bị của giáo viên: -Đề kiểm tra, đáp án, biểu điểm. 2/ Chuẩn bị của học sinh: -Chuẩn bị bài cũ của chương. -Giấy làm bài, giấy nháp, bút mực, máy tính... để làm bài. III) HOẠT ĐỘNG CỤ THỂ: GV phát đề kiểm tra và giám sát việc làm bài của HS. A. MA TRẬN ĐỀ Nội Dung Mức Độ Nhận Biết Hiểu Vận Dụng Thấp Vận Dụng Cao TN0 TN0 TL TN0 TL Số câu % điểm Số câu % điểm Số câu %điểm Số câu % điểm Số câu % điểm Bảng tuần hoàn các nguyên tố hóa học 2 5% 1 2,5% Sự biến đổi tuần hoàn các nguyên tố hóa học. định luật tuần hoàn 2 5% 4 10% 2 5% Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học 2 5% 2 5% 2 50% 1 2,5% 1 10% Tổng 6 15% 7 17,5% 2 50% 3 7,5% 1 10% B. ĐỀ KIỂM TRA: SỞ GD-ĐT TỈNH BÌNH ĐỊNH KIỂM TRA 1 TIẾT LẦN 2 TRƯỜNG THPT SỐ 2 PHÙ CÁT MÔN : HÓA HỌC 10 cơ bản Thời gian: 45 phút Họ và tên: Lớp : A- Phần Trắc Nghiệm: 4 điểm Câu 1: Chọn câu trả lời đúng. Trong mỗi chu kì của bảng tuần hoàn, theo chiều điện tích hạt nhân tăng dần A. Bán kính nguyên tử và độ âm điện giảm B. Bán kính nguyên tử và độ âm điện tăng C. Bán kính nguyên tử tăng và độ âm điện giảm D. Bán kính nguyên tử giảm và độ âm điện tăng Câu 2: Nguyeân toá X coù caáu hình nguyeân töû: 1s2 2s2 2p6 3s23p64s2 phuø hôïp vôùi ñaëc ñieåm naøo sau ñaây: A. X laø kim loaïi, coù 8 electron hoaù trò, nhoùm IIIA, ôû oâ soá 4 . B. X laø phi kim, coù 7 electron hoaù trò, chu kì 3, nhoùm VIIA. oâ nguyeân toá soá 22. C. X laø kim koaïi, ôû chu kì 4, coù 2 electron hoaù trò, ôû nhoùm IIA, oâ nguyeân toá soá 20. D. X laø khí hieám, ôû chu kì 2, nhoùm VIIIA, thöù töï oâ soá 10. Câu 3:Cho 2 nguyên tố A và B ở 2 chu kì liên tiếp nhau của cùng một nhóm A có tổng số proton là 22. A và B là A. N(Z=7) và P(Z=15) B. Ne(Z=10) và Mg(Z=12) C. Li(Z= 3)và K(Z=19) D. F(Z=9) và Al(Z=13) Câu 4: Cho caáu hình electron cuûa nguyeân toá sau: X1: 1s22s22p6 X2: 1s22s22p5 X3: 1s22s22p63s23p5 X4: 1s22s22p1 Nhöõng nguyeân toá naøo thuoäc cuøng moät chu kyø? A. X1, X4 B. X2, X3 C. X1, X2 D.X1, X2, X4 Câu 5: Cho các nguyên tố 7N, 6C,14Si, 8O, 9F.Cho bieát caùch saép xeáp naøo sau ñaây ñuùng theo chieàu tính phi kim giảm daàn: Si, C, N, O, F. B. F, O, N, C, Si C. Si, C, N, O, F. D. Si, N, C, O, F. Câu 6: Cho các nguyên tố 11Na, 19K, 12Mg,13Al. Cho bieát caùch saép xeáp naøo sau ñaây ñuùng theo chieàu tính kim loaïi tăng daàn: Al, Mg, Na, K. B. K, Mg, Al, Na. C. K, Na, Mg, Al. D. Na, Mg, Al, K. Câu 7: Cho các nguyên tố 12Mg, 15P, 14Si,13Al.Cho bieát caùch saép xeáp naøo sau ñaây ñuùng theo chieàu giaù trò ñoä aâm ñieän taêng daàn: Al, Mg, P, Si. B. Mg, Al, Si, P. C. Mg, Si, P, Al. D. Si, P, Al, Mg. Câu 8: Các nguyên tố nhóm A trong bảng tuần hoàn là A. Các nguyên tố s B. Các nguyên tố p C. Các nguyên tố s và p D. Các nguyên tố d Câu 9: Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn sai là: Các nguyên tố được sắp xếp theo chiều tăng dần khối lượng nguyên tử Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân Các nguyên tố có cùng số lớp e trong nguyên tử được xếp vào 1 hàng Các nguyên tố có cùng e hóa trị trong nguyên tử được xếp vào một cột Câu 10: Nguyên tố hóa học A có số hiệu nguyên tử là 19, chu kì 4, nhóm IA. Khẳng định nào sau đây là sai A. Số e ở lớp vỏ của A là 19 B. Vỏ của nguyên tố A có 4 lớp e và lớp ngoài cùng có 2e C. Hạt nhân của A có 19 proton D. Nguyên tố hóa học này là một kim loại Câu 11: Cho dãy các nguyên tố nhóm IA theo thứ tự Li-Na-K-Rb. Từ Li đến Rb theo chiều điện tích hạt nhân tăng. Tính kim loại thay đổi theo chiều A. Giảm dần B. Giảm rồi tăng C. Tăng rồi giảm D. Tăng dần Câu 12: : Trong baûng tuaàn hoaøn, caùc nguyeân toá thuoäc nhoùm naøo sau ñaây coù hoaù trò cao nhaát vôùi oxi baèng I ? A. Nhoùm VIA B. Nhoùm IIA C. Nhoùm IA D. Nhoùm VIIA Câu 13: Điều khẳng định nào sau đây là đúng khi nói về nhóm IA Dễ dàng nhường 2e lớp ngoài cùng để đạt cấu hình bền Dễ dàng nhường 1e để đạt cấu hình bền Được gọi là nhóm kim loại kiềm thổ D. Dễ dàng nhận 1e để đạt cấu hình bền Câu 14: Cho dãy nguyên tố F, Cl, Br, I. Độ âm điện của dãy nguyên tố trên biến đổi như thế nào theo chiều tăng của điện tích hạt nhân? A. Tăng dần B. Giảm dần C. Không đổi D. Vừa tăng vừa giảm Câu 15:Cho các nguyên tố 16S, 15P, 14Si,13Al. Cho bieát caùch saép xeáp naøo sau ñaây ñuùng theo chieàu tính axit cuûa hôïp chaát oxit vaø hiñroxit yeáu daàn: Si, Al, S, P. B. S, P, Si, Al. C. P, S, Al, Si. D. Al, Si, P, S. Câu 16: Nguyên tố X có cấu hình e hóa trị là 3d104s2. Vậy X thuộc A. Chu kì 4 nhóm IB B. Chu kì 4 nhóm IIA C. Chu kì 4 nhóm VIA D. Chu kì 4 nhóm IIB II- Phần Tự Luận. 6 Điểm Câu 1( 2 điểm): R là nguyên tố nhóm A. Oxit cao nhất của R là RO3. Trong hợp chất với Hiđro, Hiđro chiếm 5,88% về khối lượng Xác định R Cho biết tính chất hóa học cơ bản của R, Oxit cao nhất, hợp chất khí với Hiđro, Hiđroxit tương ứng, Hiđroxit có tính axít hay bazơ Câu 2 ( 3 điểm): Cho hai nguyên tố X và Y ở hai ô liên tiếp nhau trong một chu kì của bảng HTTH và có tổng số proton bằng 27. Xác định ZX,ZY ? Viết cấu hình electron nguyên tử X và Y. Xác định vị trí của X,Y trong bảng HTTH. Câu 3(1 điểm): Cho 7,8 gam moät kim loaïi R thuoäc nhoùm kim loaïi ñieån hình (thuoäc nhoùm IA) taùc duïng vôùi nöôùc sau phaûn öùng taïo ra 2,24 lít khí hiñro (ño ôû ñktc). Vaäy kim loaïi ñoù laø? Cho Li (M=7); Na(M=23); Ca( M=40);K(M=39); O(M=16); H(M=1); S(M=32) Chú ý: Làm phần trắc nghiệm ở đề kiểm tra, tự luận ở giấy kiểm tra C. Đáp Án- Thang Điểm Phần Trắc Nghiệm ( 4 Điểm).Đúng mỗi câu 0,25 điểm. Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 D C A D B A B C A B D C B B B D Phần Tự Luận ( 5 Điểm) Câu 1(2 điểm): (1 điểm): Xác định R. Lập công thức hợp chất với hidro: RH2 và tính MR = 32 => R là lưu huỳnh (S) .đúng đạt 1 điểm. b) ( 1 điểm): S có tính chất của một phi kim, SO 3 và S(OH)6 có tính axit.đúng đạt 1 điểm. Bài 2: a) (1 điểm) ta có ZX + ZY = 27 (1) ; ZY - ZX = 1 (2) ; Giải hệ 2 pt 1 và 2 ta được:ZX = 13; ZY = 14 . đúng đạt 1 điểm b) viết cấu hình electron:(1 điểm) (ZX = 13)1s2 2s2 2p6 3s2 3p1 (ZY = 14)1s2 2s2 2p6 3s2 3p2 Xác định vị trí:(1 điểm) X nằm ở ô 13, chu kì 3, nhóm IIIA. Y nằm ở ô 14, chu kì 3, nhóm IVA. Câu 3: (1 điểm) Ta có: nH2= 2,24/22,4= 0,1 mol. nR = 0,1x 2= 0,2 mol => MR = 7,8/0,2=39 .là kali(K). Kết quả Lôùp Só soá Gioûi Khaù TB Yeáu Keùm 10A13 10A15 10A17 10A21 10A22 V/ Rút kinh nghiệm, bổ sung:
Tài liệu đính kèm:
 TIẾT 21.doc
TIẾT 21.doc





