Phân phối chương trình chủ đề tự chọn môn Hóa 10
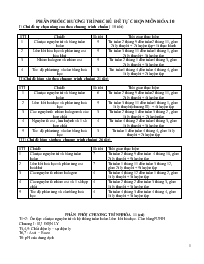
1 Cấu tạo nguyên tử và bảng tuần hoàn 5 Từ tuần 2 tháng 9 đến tuần 2 tháng 11, gồm 2t lý thuyết + 2t luyện tập+ 1t thực hành
2 Liên kết hóa học và phản ứng oxi hóa khử 5 Từ tuần 3 tháng 11 đến tuần 1 tháng 1, gồm 2t lý thuyết+ 3t luyện tập
3 Nhóm halogen và nhóm oxi 5 Từ tuần 2 tháng 1 đến tuần 4 tháng 3, gồm 2t lý thuyết + 3t luyện tập
4 Tốc độ phản ứng và cân bằng hoá học 3 Từi tuần 1 tháng 4 đến tuần 4 tháng 4, gồm 1t lý thuyết + 2t luyện tập
II/ Chủ đề bám sát theo chương trình chuẩn( 21 tiết)
STT Chủ đề Số tiết Thời gian thực hiện
1 Cấu tạo nguyên tử và bảng tuần hoàn 6 Từ tuần 2 tháng 9 đến tuần 2 tháng 11, gồm 2t lý thuyết + 4t luyện tập
2 Liên kết hoá học và phản ứng hoá học 5 Từ tuần 3 tháng 11 đến tuần 1 tháng 1, gồm 1t lý thuyết(chương III) + 4t luyện tập
3 Các nguyên tố nhóm halogen và các hợp chất 3 Từ tuần 2 tháng 1 đến tuần 3 tháng 2 , gồm 1t lý thuyết + 2t luyệntập
4 Nguyên tố oxi , lưu huỳnh và 1 số hợp chất 4 Từ tuần 4 tháng 2 đến tuần 4 tháng 3, gồm 1t lý thuyết + 3t luyện tập
5 Tốc độ phản ứng và cân bằng hoá học 3 Từ tuần 1 đến tuần 4 tháng 4, gồm 1t lý thuyết + 2t luyện tập
PHÂN PHỐI CHƯƠNG TRÌNH CHỦ ĐỀ TỰ CHỌN MÔN HÓA 10 I/ Chủ đề tự chọn nâng cao theo chương trình chuẩn ( 18 tiết) STT Chủ đề Số tiết Thời gian thực hiện 1 Cấu tạo nguyên tử và bảng tuần hoàn 5 Từ tuần 2 tháng 9 đến tuần 2 tháng 11, gồm 2t lý thuyết + 2t luyện tập+ 1t thực hành 2 Liên kết hóa học và phản ứng oxi hóa khử 5 Từ tuần 3 tháng 11 đến tuần 1 tháng 1, gồm 2t lý thuyết+ 3t luyện tập 3 Nhóm halogen và nhóm oxi 5 Từ tuần 2 tháng 1 đến tuần 4 tháng 3, gồm 2t lý thuyết + 3t luyện tập 4 Tốc độ phản ứng và cân bằng hoá học 3 Từi tuần 1 tháng 4 đến tuần 4 tháng 4, gồm 1t lý thuyết + 2t luyện tập II/ Chủ đề bám sát theo chương trình chuẩn( 21 tiết) STT Chủ đề Số tiết Thời gian thực hiện 1 Cấu tạo nguyên tử và bảng tuần hoàn 6 Từ tuần 2 tháng 9 đến tuần 2 tháng 11, gồm 2t lý thuyết + 4t luyện tập 2 Liên kết hoá học và phản ứng hoá học 5 Từ tuần 3 tháng 11 đến tuần 1 tháng 1, gồm 1t lý thuyết(chương III) + 4t luyện tập 3 Các nguyên tố nhóm halogen và các hợp chất 3 Từ tuần 2 tháng 1 đến tuần 3 tháng 2 , gồm 1t lý thuyết + 2t luyệntập 4 Nguyên tố oxi , lưu huỳnh và 1 số hợp chất 4 Từ tuần 4 tháng 2 đến tuần 4 tháng 3, gồm 1t lý thuyết + 3t luyện tập 5 Tốc độ phản ứng và cân bằng hoá học 3 Từ tuần 1 đến tuần 4 tháng 4, gồm 1t lý thuyết + 2t luyện tập III/ Chủ đề bám sát theo chương trình chuẩn( 26 tiết) STT Chủ đề Số tiết Thời gian thực hiện 1 Cấu tạo nguyên tử và bảng tuần hoàn 7 Từ tuần 2 tháng 9 đến tuần 4 tháng 10, gồm 2t lý thuyết + 5t luyện tập 2 Liên kết hoá học và phản ứng oxi hoá khử 7 Từ tuần 1 tháng 11 đến tuần 3 tháng 12, gồm 2t lý thuyết + 5t luyện tập 3 Các nguyên tố nhóm halogen 4 Từ tuần 4 tháng 12 đến tuần 1 tháng 2, gồm 1t lý thuyết + 3t luyện tập 4 Các nguyên tố nhóm oxi và 1 số hợp chất 4 Từ tuần 2 tháng 2 đến tuần 3 tháng 3, gồm 1t lý thuyết + 3t luyện tập 5 Tốc độ phản ứng và cân bằng hoá học 4 Từ tuần 4 tháng 3 đến tuần 4 tháng 4, gồm 1t lý thuyết + 3t luyện tập PHÂN PHỐI CHƯƠNG TRÌNH HÓA 11 (củ) T1+2: Ôn tập: cấu tạo nguyên tử và hệ thống tuần hoàn. Liên kết hóa học. Cân bằng PƯHH Chương I : SỰ ĐIỆN LY T3,4,5: Chất điện ly – sự điện ly T6,7 : Axit – Bazơ T8: pH của dung dịch T9 : luyện tập T10 : Muối T11 , 12 : Phản ứng trao đổi ion . Luyện tập T13 : Thực hành bài số 1: “ Axit – Bazơ – Muối” T14 : Ôn tập chương I T15: Kiểm tra viết Chương II: NITƠ – PHOTPHO T16 : Mỡ đầu, Nitơ T17 ,18,19: Amoniac. Dung dịch amoniac. Muối amoni T20: Sản xuất amoniac T21 : Luyện tập T22 , 23: Axit Nitric T24: Thưc hành bài 2: “ Amoni – Axit Nitric T25 : Luyện tập T26: Kiểm tra viết T27 : Photpho T28: Axit photphoric T29, 30: Phân bón hóa học T31: Thưc hành bài 3: “ Phân bón hoá học “ T32, 33: ôn tập HKI T34: Kiểm tra HKI Chương III: ĐẠI CƯƠNG HÓA HỌC HỮU CƠ T35: Mỡ đầu T36 , 37: Thành phần nguyên tố và công thức phân tử T 38 , 39: Cấu tạo phân tử hợp chât hữu cơ T40: Thực hành bài 4 : “ Phân tích định tính nguyên tố” Chương IV: HIĐROCACBON NO T 41, 42, 43: Dãy đồng đẳng của Mêtan. Xicloankan T44 ,45 : ôn tập chương III, IV T46: Kiểm tra Chương V: HIĐROCACBON KHÔNG NO T47, 48, 49: Dãy đồng đẳng của etylen. Luyện tập T50 ,51: Ankadien. Cao su T52, 53: Dãy đồng đẳng của Axetylen T54: Luyện tập Chương VI: HIĐROCACBON THƠM T 55, 56, 57: Benzen và các chất đồng đẳng. Một số hiđrocacbon thơm khác T58: thưc hành bài 5:” điều chế và tính chất của hiđrocacbon “ T59: Ôn tập chương V, VI T60: Kiểm tra Chương VII: NGUỒN HYĐROCACBON TRONG THIÊN NHIÊN T61, 62: Khí thiên nhiên. Dầu mỏ. Sự chưng cất than đá T63, 64: Ôn tập HKII T65: Kiểm tra HKII T66: Tổng kết cuối năm LỚP 12 T1: Ôn tập:những điểm cơ bản của thuyết cấu tạo hóa học. Đồng phân. Đặc điểm về cấu tạo , tính chất hóa học của mỗi loại hiđrocacbon Chương I: RƯỢU – PHENOL – AMIN T2,3,4: Nhóm chức và dãy đồng đẳng của rượu êtylic T5: Phenol T6: Khái niệm về amin. Anilin T7: Thực hành bài 1:” TC của rượu, phenol và amin T8: Ôn tập T9: kiểm tra Chương II: ANĐEHIT – AXIT CACBONXYLIC – ESTE T10: Anđehit fomic T11: Dãy đồng đẳng vcủa andehit fomic T12,13,14: Dãy đồng đẳng của axit axetic( đọc thêm điều chế axit axetic từ axetylen). Khái niệm về axit cacboxylic. Luyện tập T15,16: Mối liên quan giữa hiđrocacbon, rượu, anđehit và axit cacboxylic. Luyện tập T17: Este Chương III: GLYXERIN – LIPIT T18,19: khái niệm về hợp chất hữu cơ có nhiều nhóm chức. glyxerin.lipit T20: Ôn tập chương II, III T21: Kiểm tra Chương IV: GLUXIT T22: Gluxit – Glucozo T23: Saccarozo T24: Tinh bột T25: Xenlulozo Chương V: AMINOAXIT – PROTIT T26: Aminoaxit T27: Protit T28: Ôn tập chương IV, V Chương VI: HỢP CHẤT CAO PHÂN TỬ VÀ VẬT LIỆU POLIME T29: Khái niệm chung T30: Chất dẽo, tơ tổng hợp T31: Thực hành bài 2: “tính chất glyxerin, gluxit, protit và polime” T32: Ôn tập HKI T33: Kiểm tra HKI Chương VII: ĐẠI CƯƠNG VỀ KIM LOẠI T34: Vị trí của kim loại trong bảng HTTH. Cấu tạo của kim loại T35: Tính chất vật lí của kim loại T36: Tính chất hoá học chung của kim loại T37: Dãy điện hoá của kim loại T38: Hợp kim T39,40: Aên mòn kim loại và cách chồng ăn mòn T41: Điều chế kim loại T42: Ôn tập chương VII T43: Kiểm tra Chương VIII: KIM LOẠI CÁC PHÂN NHÓM CHÍNH NHÓM I, II, III T45,46,47: Kim loại phân nhóm chính nhóm I. một số hợp chất quan trọng của Natri T47: Kim loại phân nhóm chính nhóm II T48: Một số hợp chất quan trọng của Canxi T49: Nước cứng T50: Luyện tập T51,52,53: Nhôm. Hợp chất của nhôm. Một số hợp kim quan trọng của nhôm T54: Sản xuất nhôm T55: Thực hành bài 3: “Tính chất của kim loại kiềm, kim loại kiềm thổ, nhôm” T56: Ôn tập chương VIII T57: Kiểm tra Chương IX: SẮT T58,59,60: Cấu tạo –tính chất của sắt. Hợp chất của sắt T61,62,63: Sản xuất gang thép T64: Thực hành bài 4: “ Tính chất của sắt và hợp chất sắt “ T65: Ôn tập HKII T66: Kiểm tra HKII Ngày soạn: Ngày giảng: Lớp Tiết TTKB Sĩ số Tiết 1: LÝ THUYẾT VỀ CHƯƠNG CẤU TẠO NGUYÊN TỬ I/ Mục tiêu bài học: 1/ Về kiến thức: HS nắm vững: Thành phần cấu tạo nguyên tử và đặc điểm của các loại hạt p , n , e . Khái niệm nguyên tố hoá học và đồng vị ? Biết cách tính nguyên tử khối trung bình của các đồng vị? Viết cấu hình electron của 20 nguyên tố đầu 2/ Về kỉ năng: rèn luyện kỹ năng tư duy, phán đoán và so sánh II/ Chuẩn bị: + HS ôn tập các kiến thức đã học + GV chuẩn bị câu hỏi III/ Các bước lên lớp: 1.ổn định lớp. 2.Kiểm tra bài cũ. Phối hợp trong giờ 3.Nội dung bài mới. Hoạt động của thầy và trò Nội dụng ghi bảng Hoạt động 1: GV cho HS thảo luận kiến thức về thành phần nguyên tử theo dạng câu hỏi: Thế nào là một đơn vị khối lượng nguyên tử ? Hãy tính đơn vị khối lượng nguyên tử (u) ra gam ? Trong các hạt sau đây: electron , proton , nơtron. Hạt nào mang điện tích dương, hạt nào mang điện tích âm, hạt nào không mang điện HS trả lời Hoạt động 2: GV: Cho HS vận dụng giải các bài tập 1,2,3 HS:Làm bài tập Hoạt động 3: GV củng cố kiến thức về hạt nhân nguyên tử, nguyên tố hóa học, đồng vị Hoạt động 4: -BTVN. -Rút kinh nghiệm. I.Lý thuyết: Khối lượng của 1 nguyên tử đồng vị cacbon (mC) -Một đơn vị khối lượng nguyên tử bằng 1/12 khối lượng của 1 nguyên tử đồng vị cacbon 12 (mC) II.Bài tập Bài 1: 1/ Hãy cho biết số đơn vị điện tích hạt nhân, số proton, số nơtron, số electron và số khối của các nguyên tử sau: 2/ Trong các đồng vị sau đây: a/ Đồng vị nào không có nơtron? b/ Đồng vị nào có số nơtron gấp đôi số proton? 3/ Hiđro có các đồng vị : và oxi có các đồng vị: . Hãy viết công thức của các loại phân tử nước khác nhau ? Bài 2: 1/ Hãy cho biết điều khẳng định nào dưới đây là đúng ? a/ Trong 1 nguyên tử số nơtron luôn bằng số electron b/ Trong 1 nguyên tử số nơtron luông bằng số proton c/ Trong 1 ngyên tử số proton luông bằng số electron 2/ a/ Hãy cho biết tên các phân lớp thuộc lớp N ? b/ Hãy cho biết số e tối đa có thể phân bố trên: phân lớp s, phân lớp p, phân lớp d, phân lớp f ? 1/ Hãy cho biết nguyên tắc phân bố các electron trên các lớp và các phân lớp ? (1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p ...) 2/ Viết cấu hình electron của từng cặp các nguyên tử sau và nhận xét số electron ngoài cùng của các nguyên tử này ? a/ Li (Z=3) , Na ( Z= 11) b/ Fl (Z=9) , Cl ( Z= 17) c/ Ne ( Z= 10) , Ar ( Z= 18) Tiết 2: LUYỆN TẬP VỀ CẤU TẠO NGUYÊN TỬ I/ Mục tiêu bài học: 1/ về kiến thức: củng cố các kiến thức về thành phần cấu tạo nguyên tử, xác định nguyên tử khối trung bình của các đồng vị 2/ về kỉ năng: rèn luyện kỉ năng vận dụng kiến thức để giải bài tập II/ Chuẩn bị: GV cho HS ghi trước đề các bài tập III/ Hoạt động dạy học: HOẠT ĐỘNG CỦA THẦY HOẠT ĐỘNG CỦA TRÒ Hoạt động 1: GV cho HS nhắc lại kiến thức: +Đặc điểm các hạt cấu tạo nên nguyên tử +Khái niệm về đồng vị +Công thức tính nguyên tử khối trung bình Hoạt động 2: GV hướng dẩn HS giải các bài tập sau: Bài 1: Nguyên tử khối trung bình của Bạc là 108. Trong đó chiếm 44%, còn lại là đồng vị thứ hai. Xác định nguyên tử khối của đồng vị thứ hai ? Bài 2:Oxi có 3 đồng vị là: Gọi x1,x2,x3 là phần trăm số nguyên tử của 3 đồng vị này. Với x1 = 15 x2 và x1 – x2 = 21 x3. Tính nguyên tử khối trung bình của oxi ? (ĐS: 16,14) Bài 3: Cho nguyên tử X có tổng số các loại hạt là 155, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 33 hạt.Tính : a/ số khối của nguyên tử X ? b/ Viết kí hiệu nguyên tử của X ? Bài 4: Tổng số hạt p,n,e trong nguyên tử của một nguyên tố là 13. tính số khối của nguyên tố đó ? HS phân tích đề và điền dữ liệu đề cho vào công thức liên quan rồi giải: Phần trăm của đồng vị thứ hai là: 100% - 44% = 56% Gọi Y là nguyên tử khối của đồng vị thứ hai, áp dụng công thức ta có: Giải ra ta được Y = 107 -HS dựa vào đầu đề để giải -GV hướng dẩn:x1+ x2+x3=100 (*) 14x2=21x3 --> x3=x2 Thế các giá trị x1, x3 vào (*) tìm x2 ? + HS phân tích: trong nguyên tử hạt nào mang điện , hạt nào không mang điện + Dựa vào đầu đề lập biểu thức để tính p + n + e = 155 --> 2p +n = 155 (1) 2p = n + 33 --> 2p – n = 33 ( 2) Từ (1),(2) ta có: p= 47 suy ra n = 94 – 33 = 61 Vậy số khối của X là A= 47 + 61=108 GV lưu ý HS: đối với các nguyên tử có (Z 82) thì áp dụng bất đẳng thức sau: (*) Theo đề bài ta có : 2p + n=13 n = 13 – 2p Thế giá trị n vào (*) rồi giải bất đẳng thức tìm p: + + . Do p có giá trị nguyên dương , nên ta chọn p =4 Suy ra n = 13 – 8 = 5 Vậy số khối của nguyên tử này là:5+4= 9 IV/ Bài tập về nhà: Bài 1: Cho nguyên tử Y có tổng số các loại hạt là 58. Trong đó hạt nơtron hơn hạt proton 1 đơn vị. Xác định số khối của Y ? Bài 2: Cho 11,7 gam muối NaX tác dụng với dung dịch AgNO3 dư, thì thu được 28,7 gam một chất kết tủa trắng a/ Xác định khối lượng nguyên tử của X ? b/ X có hai đồng vị, cho biết đồng vị thứ hai hơn đồng vị thứ nhất là 2 nơtron và đồng vị thứ hai chiếm 75%. Tính số khối của mỗi đồng vị ? HD: PTPƯ : NaX + AgNO3 --> NaNO3 + AgX Tiết 3: LUYỆN TẬP VỀ VÕ NGUYÊN TỬ I/ Mục tiêu bài học: 1 ... a/ Cho 7,3 gam HCl tác dụng với MnO2 b/ Cho 7,3 gam HCl tác dụng với KMnO4 Tiết 10: LUYỆN TẬP I/ Mục tiêu bài học: 1/ Về kiến thức: củng cố kiến thức về tính chất hoá học và điều chế của clo, axit clohydric, nước ja-ven, clorua vôi 2/ Về kỉ năng: rèn luyện kỉ năng giải bài tập hóa học II/ Chuẩn bị : HS ôn tập các kiến thức đã học III/ Phương pháp: vấn đáp, đặt vấn đề và giải quyết vấn đề IV/ Hoạt động dạy học: HOẠT ĐỘNG CỦA THẦY HOẠT ĐỘNG CỦA TRÒ Hoạt động 1: GV củng cố kiến thức về clo, axit clohydric, các hợp chất chứa oxi của clo Hoạt động 2: GV hướng dẩn HS nhận biết ion clorua. GV làm mẫu một bài, HS thực hiện các bài khác Hoạt động 3: GV nêu một số dạng bài tập tính toán hoá học và hướng dẩn cách giải Bài 1: Cho 10 gam hổn hợp gồm Fe và Cu vào 500 ml dung dịch HCl ,thì thu được 5,6 lít khí ( ĐKC) a/ Xác định % về khối lượng của mỗi kim loại trong hổn hợp ? b/ Tính nồng độ mol/ lít của dung dịch HCl Bài 2: Cho 6,8 gam hổn hợp gồm Mg và Fe vào dung dịch H2SO4 loãng dư, sau phản ứng thu được 3,36 lít khí ở ĐKC. Xác định % về khối lượng của mỗi kim loại trong hổn hợp ? Bài 3: Để hòa tan hổn hợp gồm Zn và ZnO người ta dùng 120 gam dd HCl 36,5%, sau phản ứng giải phóng 0,4 mol khí. Xác định khối lượng của hổn hợp ? + HS thực hiện các chuổi phản ứng sau: a/ KMnO4 à Cl2 à FeCl3 àFe(OH)3 à Fe2O3 à Fe2(SO4)3 b/ MnO2 à Cl2 à HCl à FeCl2 à Fe(OH)2 à FeO à FeSO4 c/ HCl à FeCl3 à Fe(OH)3 à Fe2O3 à Fe2(SO4)3 d/ Al à Al2O3 à AlCl3 à Al(OH)3 à Al2(SO4)3 + HS thực hiện nhận biết các chất sau: a/ HCl , NaOH , NaCl, NaNO3 b/ HCl , HNO3 , NaOH , NaCl c/ HNO3 , HCl , NaCl , NaNO3 GV hướng dẩn: CT tính % về khối lượng của một kim loại VD: HS tự giải GV lưu ý HS là cả 2 kim loại đều tác dụng với dd H2SO4. do đó lượng khí sinh ra là do cả 2 kim loại tác dụng mà có, nên đặt x là số mol của Mg và y là số mol của Fe HS xác định hệ phương trình để giải x + y = 3,36 / 22,4 24 x + 56 y = 6,8 GV hướng dẩn: + xác định số mol HCl + Dựa vào PT của Zn với HCl và số mol khí ta xác định số mol kẽm và số mol HCl tham gia phản ứng + Xác định số mol HCl còn lại + Viết PT của HCl với ZnO, xác định số mol ZnO + Từ đó xác định khối lượng của hổn hợp V/ Bài tập về nhà: Bài 1: Hòa tan 10 gam hồn hợp gồm Mg và Ag vào dung dịch HCl dư . sau phản ứng thu được 5,6 lít khí ở ĐKC a/ Xác định % về khối lượng của mỗi kim loại trong hổn hợp ? b/ Tính thể tích dung dịch HCl 0,1 M cần dùng ? Bài 2: Cho 10,3 gam hổn hợp gồm Cu , Fe , Al vào dung dịch HCl dư , sau phản ứng thu được 5,6 lít khí ở ĐKC và 2 gam một chất rắn không tan . Tính % về khối lượng của mỗi kim loại trong hổn hợp ? Bài 3: Cho 5,94 gam hổn hợp gồm Na2CO3 và K2CO3 tác dụng vưa dử với 500 ml dung dịch H2SO4 , sau phản ứng thu được 1,12 lít khí (ĐKC) a/ Tính khối lượng mỗi muối trong hổn hợp ? b/ Tính nồng độ mol / lít của dung dịch H2SO4 ? Tiết 11: HỆ THỐNG HÓA CHƯƠNG HALOGEN I/ Mục tiêu bài học: 1/ Về kiến thức: củng cố kiến thức chương halogen 2/ Về kỉ năng: rèn luyện kỉ năng viết phương trình phản ứng và giải các bài tập hóa học II/ Chuẩn bị : HS ôn tập các kiến thức đã học III/ Phương pháp: vấn đáp, đặt vấn đề và giải quyết vấn đề IV/ Hoạt động dạy học: HOẠT ĐỘNG CỦA THẦY HOẠT ĐỘNG CỦA TRÒ Hoạt động 1:hệ thống hoá kiến thức -GV yêu cầu HS cho biết số e ở lớp ngoài cùng của các nguyên tố halogen ? -HS viết PTPƯ chứng minh tính oxi hóa mạnh của các halogen ? -GV nhắc lại các phương pháp sản xuất các halogen trong công nghiệp -HS viết các PTPƯ điều chế clo trong PTN GV hệ thống tính axít bằng sơ đồ HF HCl HBr HI Tính axit, tính khử tăng dần GV yêu cầu HS viết PT nhận biết các muối halogenua Tại sao nước gia-ven có tính oxi hóa mạnh. Hoạt động 2: GV hướng dẩn HS giải bài tập có tính toán 1/ Tính chất hóa học của các nguyên tố halogen + Lớp ngoài cùng của các nguyên tố halogen có 7e (ns2np5)nên có khuynh hướng nhận 1e để đạt cấu hình bền giống khí hiếm. Do đó các halogen có tính oxi hóa mạnh( oxi hoá hầu hết các kim loại, tác dụng mạnh với hidro) + Flo luôn có số oxi hóa -1 trong các hợp chất vì flo có độ âm điện lớn nhất. Còn clo, brom, iot ngoài số oxi hóa -1, còn có số oxi hóa +1,+3,+5,+7 trong các hợp chất vì độ âm điện của chúng nhỏ hơn của oxi. 2/ Phương pháp sản xuất công nghiệp các halogen: a/ Flo: điện phân hổn hợp KF và HF( thể lỏng) b/ Clo: điện phân dung dịch NaCl bão hoà ( có màng ngăn) c/ Brom: dùng clo để oxi hóa Br- trong NaBr, KBr( được tách từ nước biển) Cl2 + 2NaBr à2 NaCl + Br2 d/ Iot: Tách NaI từ rong biển, sau đó oxi hóa ion I- trong NaI thành I2 bằng khí clo Cl2 + 2NaI à 2NaCl + I2 3/ Hợp chất của các nguyên tố halogen: a/ hợp chất với hidro(HX) + HX là những hợp chất khí, dungb dịch của chúng trong nước có tính axít mạnh ( trừ HF là axít yếu) + HX(trừ HF) thể hiện tính khử khi tác dụng với các chất oxi hoá mạnh b/ Muối halogenua: nhận biết bằng dung dịch AgNO3 NaF + AgNO3 à không tác dụng c/ Hợp chất có oxi của clo: + Nước gia-ven:là hổn hợp NaCl, NaClO trong dung dịch nước. Nước gia-ven có tính oxi hoá mạnh vì clo có số oxi hóa +1 trong NaClO + Clorua vôi: là muối hổn tạp tạo bởi kim loại canxi liên kết với 2 gốc axít là clorua và hipoclorit +Bài tập 11 SGK trang 119: Số mol NaCl và AgNO3: a/ NaCl + AgNO3 à AgCl + NaNO3 0,1 0,1 0,1 0,1 mAgCl=143,5 x 0,1 = 14,35 gam b/ Vdd = 300 + 200 = 500 ml + Bài tập 13 SGK trang 119: Dẫn khí oxi có lẩn tạp chất khí Cl2 đi qua dung dịch kiềm, chỉ có khí Cl2 tác dụng tạo ra muối tan vào dung dịch. Khí đi ra là O2 tinh khiết Tiết 12: LÝ THUYẾT: TÍNH CHẤT HÓA HỌC CỦA OXI, LƯU HUỲNH VÀ ĐIỀU CHẾ OXI I/ Mục tiêu bài học: 1/ Về kiến thức: củng cố kiến thức về tính chất hoá học và điều chế oxi, 2/ Về kỉ năng: rèn luyện kỉ năng giải bài tập hóa học II/ Chuẩn bị : HS ôn tập các kiến thức đã học và các bài tập ở SGK III/ Phương pháp: vấn đáp, đặt vấn đề và giải quyết vấn đề IV/ Hoạt động dạy học: HOẠT ĐỘNG CỦA THẦY HOẠT ĐỘNG CỦA TRÒ Hoạt động 1: + Yêu cầu HS viết cấu hình electron của nguyên tử oxi và lưu huỳnh ? Từ đó xác định số e ở lớp ngoài cùng ? + GV giải thích tại sao lưu huỳnh có tính oxi hoá yếu hơn oxi ? + Yêu cầu HS viết các PTHH thể hiện tính oxi hoá của oxi ? + GV sữa sai + Tại sao lưu huỳnh vừa có tính oxi hoá , vừa có tính khử ? + Yêu cầu HS nêu cách điều chế oxi trong PTN GV giới thiệu các phương pháp sản xuất oxi trong công nghiệp I/Hệ thống hoá kiến thức: 1/Nguyên tử của các nguyên tố oxi và lưu huỳnh đều có 6e ở lớp ngoài cùng(ns2np4) và có độ âm điện tương đối lớn(O:3,44 – S: 2,58) nên chúng là những phi kim mạnh có tính oxi hoá mạnh(yếu hơn halogen) 2/ Tính oxi hóa của lưu huỳnh yếu hơn oxi ( vì S có độ âm điện nhỏ hơn, bán kính nguyên tử S lớn hơn oxi, lực hút của hạt nhân với e ngoài cùng của S yếu hơn oxi) VD: 3Fe +2O2 à Fe3O4 Fe + S à FeS 3/ Oxi là một phi kim mạnh, có tính oxi hoá mạnh: + Oxi oxi hoá hầu hết các kim loại tạo ra oxit (trừ vàng, bạc, bạch kim) +Oxi oxi hoá các phi kim đền số oxi hoá cao nhất của chúng: C +O2 à CO2 4P + 5O2 à 2P2O5 + Oxi oxi hoá đươc nhiều hợp chất: 2SO2 + O2 à 2SO3 C2H5OH +3O2 à 2CO2 + 3H2O 4/ Lưu huỳnh ngoài tính oxi hoá đồng thời còn có tính khử VD: S + H2 à H2S S + O2 à SO2 5/ Điều chế oxi trong phòng thí nghiệm và sản xuất oxi trong công nghiệp: + Trong PTN: nhiệt phân những hợp chất giàu oxi và dễ bị phân huỷ bởi nhiệt, giải phóng oxi như ( KMnO4 , KClO3 ) + Trong CN: Từ không khí: Hoá lõng không khí rồi chưng cất phân đoạn không khí lõng thu được oxi ( phương pháp vật lí) Từ nước: Điện phân nước( phương pháp hoá học) 2H2O à 2H2 + O2 Hoạt động 2:GV cho bài tập vận dụng, HS suy nghỉ trả lời : 1/ Cấu hình electron lớp ngoài cùng của nguyên tố oxi và lưu huỳnh là cấu hình nào sau đây ? a/ ns2np3 b) ns2np4 c/ ns2np5 d/ ns2np6 2/ Với số mol lấy bằng nhau, phương trình hoá học nào dưới đây điều chế được lượng oxi nhiều hơn ? 2KClO3 à 2KCl + 3O2 b/ 2KMnO4 à K2MnO4 + MnO2 + O2 c/ 2HgO à 2Hg + O2 d/ 2KNO3 à 2KNO2 + O2 3/ Không cần tính toán, hãy cho biết phần trăm khối lượng oxi lớn nhất là ở chất nào sau đây : a/ CuO b/ Cu2O c/ SO2 d) SO3 4/ Khi nhiệt phân 1 gam KMnO4 thì thu được bao nhiêu lít khí oxi ở (ĐKTC)? a/ 0,1 (l) b/ 0,3 (l) c) 0,07 (l) d/ 0,03 (l) Tiết 13: LUYỆN TẬP I/ Mục tiêu bài học: 1/ Về kiến thức: Củng cố tính chất của oxi, lưu huỳnh và một số hợp chất của lưu huỳnh. Qua đó biết cách vận dụng để giải các bài tập định tính, biết viết PTHH theo chuổi phản ứng 2/ Về kỉ năng: rèn luyện kỉ năng giải bài tập hóa học II/ Chuẩn bị : HS ôn tập các kiến thức đã học III/ Phương pháp: vấn đáp, đặt vấn đề và giải quyết vấn đề IV/ Hoạt động dạy học: HOẠT ĐỘNG CỦA THẦY HOẠT ĐỘNG CỦA TRÒ Hoạt động 1: GV ghi đề bài tập lên bảng Bài 1: So sánh thể tích oxi thu được (đktc) khi nhiệt phân hoàn toàn KMnO4 , KClO3 trong các trường hợp sau: a/ Các chất có cùng khối lượng b/ Các chất có cùng số mol. Bài 2:Đốt nóng một hổn hợp gồm 6,4 gam bột lưu huỳnh và 15 gam bột kẽm trong môi trường kín không có không khí. a/ Viết PTHH b/ Chất nào còn lại sau phản ứng? Khối lượng là bao nhiêu ? Bài 3: Câu nào sau đây diễn tả đúng tính chất hóa học của lưu huỳnh: A.Lưu huỳnh chỉ có tính oxi hoá B. Lưu huỳnh chỉ có tính khử C. Lưu huỳnh vừa có tính oxi hoá vừa có tính khử D. Lưu huỳnh không có tính oxi hoá và không có tính khử Bài 4: Điều chế khí oxi bằng cách nhiệt phân KMnO4. kết quả ghi lại như sau: Thời gian Thể tích O2thu được (cm3) 0 10 20 30 40 50 60 70 0 8 28 57 78 87 90 90 Bài 5: Có một hổn hợp chất rắn gồm bột lưu huỳnh và bột sắt. Nêu phương pháp hoá học tách riêng bột lưu huỳnh ra khỏi hổn hợp ? Bài 6: Thực hiện các chuổi phản ứng sau: a/ KMnO4 à O2 à Al2O3 à AlCl3à Al(OH)3 à Al2O3 à Al2(SO4)3 b/ KClO3 à O2 à SO2 à SO3 à H2SO4 à CuSO4 +HS thực hiện + GV sửa sai: PT: 2KMnO4à K2MnO4 + MnO2 + O2 (1) 2KClO3 à 2KCl + 3O2 (2) a/Nếu lấy cùng khối lượng thì lượng chất của KMnO4 nhỏ hơn của KClO3, nên thể tích oxi thu được ở PT (2) nhiều hơn (1) b/ Cùng số mol thì thể tích oxi thu được ở PT (2) nhiều hơn PT (1) PTHH: Zn + S à ZnS 32 x? 6,4 Vậy lượng kẽm dư là 2 gam HS chọn lựa đáp án đúng HS vẽ đồ thị biểu diễn thể tích khí oxi thu được theo thời gian ? Khuấy hổn hợp trong dung dịch axit ( HCl hoặc H2SO4)dư cho đến khi không còn bọt khí thoát ra. Lọc hổn hợp sau phản ứng và rửa sạch, được bột lưu huỳnh HS lên bảng thực hiện Tiết 14 BÀI TẬP I/ Mục tiêu bài học: 1/ Về kiến thức: Củng cố tính chất của các halogen,các hợp chất của clo, oxi, lưu huỳnh và một số hợp chất của lưu huỳnh. Qua đó biết cách vận dụng để giải các bài tập định tính, biết viết PTHH theo chuổi phản ứng 2/ Về kỉ năng: rèn luyện kỉ năng giải bài tập hóa học II/ Chuẩn bị : HS ôn tập theo đề cương ôn tập HK2 III/ Phương pháp: đặt vấn đề và giải quyết vấn đề IV/ Hoạt động dạy học: Hoạt động 1: GV hướng dẩn HS giải các bài tập định lượng trong đề cương ôn tập HK2
Tài liệu đính kèm:
 tu chon10 hoa.doc
tu chon10 hoa.doc





